
Dev Cell. 2024 Nov 2; S1534-5807(24)00607-5. doi: 10.1016/j.devcel.2024.10.007. Online ahead of print.
【ポイント】
- ヒト舌がんの化学療法剤抵抗性メカニズムを解明しました。
- 舌がん患者から舌がんオルガノイドライブラリーの樹立に成功、一部は化学療法剤抵抗性を示しました。
- 化学療法剤抵抗性舌がんオルガノイドはオートファジーやコレステロール合成が亢進しており、これらを阻害すると化学療法剤感受性に変化しました。
- 舌がん再発の原因となる微小残存病変の形成メカニズムを解明し、新たな根治療法の開発が期待されます。
【Points】
- Elucidation of the mechanism of resistance to chemotherapeutic agents in human tongue cancer.
- A tongue cancer organoid library was successfully established from tongue cancer patients, some of whom showed resistance to chemotherapeutic agents.
- Chemotherapeutic drug-resistant tongue cancer organoids have enhanced autophagy and cholesterol synthesis, and inhibition of these pathways transformed them into chemotherapeutic drug-sensitive tongue cancer organoids.
- By elucidating the mechanism of minimal residual disease formation that causes the recurrence of tongue cancer, it is hoped that new curative therapies can be developed.
【研究の背景】
舌がんは、口腔癌の中で最も発生頻度が高く、悪性度も高いがんであり、舌がん患者の20〜40%は早期に頸部リンパ節へ転移することが知られています。治療の第一選択は手術であり、再発や転移のリスクが高い舌がんには術後化学放射線療法が施されますが、治療後の再発率は依然として高く、再発した舌がん患者の5年生存率は約40%です。また、舌がんの外科的切除は、術後の患者QOLを著しく低下させるため、治療抵抗性の舌がんを根絶するための新しい治療法の開発が求められています。
これまで、ヒトの前臨床がんモデルとしてはがん細胞株が広く用いられてきましたが、個別化医療に必要な患者間の腫瘍特性の違い(不均一性)を再現することは不可能でした。近年、患者ごとのがんの不均一性をin vitroで再現できる新しいモデルとして、患者由来のがんオルガノイドが確立され、患者個別の抗がん剤スクリーニングやがんの性状解析に有用であることが示されています。これまでに、大腸がん、肝臓がん、膵臓がん、乳がん、前立腺がんなどのがんオルガノイドが樹立されていますが、舌がんに特化したがんオルガノイドライブラリーは存在しませんでした。
微少残存病変(MRD)は、化学療法剤投与後にも残存し、再発の原因となりうる少数のがん細胞です(図1)。化学療法剤抵抗性を獲得するがん細胞の特徴は、胚性休止期(用語8)の特徴と類似していると言われています。しかし、MRDに関する研究の多くはがん細胞株を用いて行われているため、患者間および患者内腫瘍の不均一性を再現できるがんオルガノイドを用いたMRD形成メカニズムの解明が必要とされていました。

図1. がん再発の原因となる微小遺残病変
がん発生初期から、がん細胞は、血管やリンパ管を介して、遠隔臓器やリンパ節に微小転移している場合がある。原発腫瘍の切除手術と、その後の補助化学療法後に生き延びたがん細胞(微小残存病変、MRD)は、数ヶ月から数年を経て、転移組織においてがん再発を引き起こす可能性がある。
【研究成果の概要】
化学療法後の舌がんの再発は、化学療法後に残存するMRDによって引き起こされます。私たちは舌がんにおけるMRD形成メカニズムを理解するため、未治療の舌がん患者28人の腫瘍組織を再現した舌がんオルガノイドライブラリーを樹立しました。これらの舌がんオルガノイドは、in vitroでも異種移植モデル(用語9)でも元の舌がん組織の特性を再現し、一部の舌がんオルガノイドはシスプラチン(用語10)処理後も生存しました(化学療法抵抗性舌がんオルガノイド)。特に注目すべき点として、化学療法抵抗性の舌がんオルガノイドは、シスプラチン処理以前から胚性休止期の特徴を示し、オートファジーとコレステロール生合成経路が活性化していました。そこで、これらの経路を特異的阻害剤で抑制したところ、化学療法抵抗性の舌がんオルガノイドが化学療法感受性を示し、死滅に至りました。逆に、mTOR阻害剤(用語11)でオートファジーを活性化させると、化学療法感受性の舌がんオルガノイドに化学療法抵抗性が付与される結果となりました(図2)。
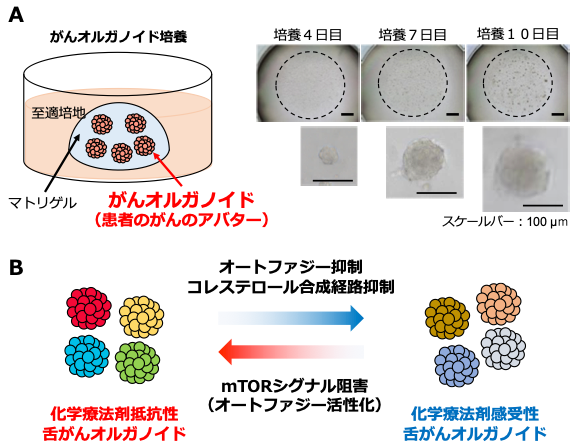
図2. 舌がんオルガノイドライブラリーを用いた化学療法抵抗性機序解明
(A)がんオルガノイド培養の模式図(左)、舌がん患者の腫瘍組織から採取したがん細胞を細胞外基質を含むマトリゲルに包埋し、至適な培地条件下で培養すると、10日ほどで直径が100~200 mmほどの大きさのオルガノイドに成長する(右) 。(B)舌がんオルガノイド株の比較から、オートファジー経路およびコレステロール合成経路の活性化が舌がんの化学療法剤抵抗性に関わることが分かった(本文参照)。
【研究成果の意義】
現在、舌がん治療の方向性を決定する際には、原発巣の広がり(T)、リンパ節転移の有無(N)、遠隔転移の有無(M)に基づくTNM分類(用語12)が判断基準とされています。しかし、同じTNM分類に属する舌がん患者であっても、予後や治療効果に違いが生じる場合があります。私たちは、舌がんオルガノイドモデルがTNM分類に依存せずに、患者ごとの腫瘍の化学療法に対する反応性を正確に予測するための極めて有用なツールであることを示しました。
例えば、本研究において、ある舌がん患者は初回治療時の臨床診断で、局所リンパ節および遠隔転移のない早期癌と診断されたため、頸部郭清を伴わない舌がん切除を受けましたが、6ヵ月以内に頸部のリンパ節転移が出現し、その後遠隔臓器へ転移しました。一方で、この患者由来の舌がんオルガノイドは化学療法剤に対して強い抵抗性を示しました。これらの結果は、TNM分類だけでは患者ごとの最適な治療を決定するには不十分である可能性を示唆しています。
舌がん患者由来のオルガノイドは、1週間で樹立でき、薬剤感受性試験も約2週間で完了します。従って、現行のTNM分類と舌がんオルガノイドプロファイリングを組み合わせることにで、各患者の舌がんに対してより正確なリスク評価に基づく適切な治療方針を早期に決定できる可能性があります。また、舌がんオルガノイドが化学療法抵抗性(MRD形成能)を示した場合、従来の化学療法に加え、MRD形成を抑制する治療法を取り入れることで、舌がんの再発抑制につながることが期待されます。
本研究の成果は、舌がんにおけるMRD形成メカニズムに関する新たな知見を提供し、舌がんの再発を抑制する効果的な治療アプローチにつながるものです。私たちが樹立した舌がんオルガノイドライブラリーは、化学療法抵抗性舌がんに対する有効な新薬標的やバイオマーカーの発見に重要なリソースとなり、効果的な個別化医療の実現に貢献することが期待されます。
用語説明
- 舌がんオルガノイドライブラリー:オルガノイドは組織の一部から作製した三次元構造体である(ミニチュアの臓器)。がんオルガノイドは、患者ごとのがんを試験管内に再現する“患者のがんのアバター”。舌がんオルガノイドライブラリーは、患者ごとの舌がんオルガノイドを多数集めたもので、図書館のように、さまざまな種類のオルガノイドが保存されている。
- オートファジー:細胞が自身のタンパク質や細胞小器官を分解しリサイクルする仕組み。近年、がん細胞の増殖や生存との関連性が注目されている。
- コレステロール合成:コレステロールは、私たちの体内で作られる脂質の一種で、アセチルCoAを原料とする。がん細胞の増殖や生存を促すことも報告されている。
- QOL:いかに充実した人生を送るかという質の高さのこと。
- 個別化医療:患者さんごとの遺伝子情報、体質、生活習慣等に基づいて、その人に最適な治療法や予防策を選択する医療のこと。
- 微小残存病変:がんの治療後、通常の検査では発見できないほどごくわずかに残っているがん細胞のこと。がんの再発や治療抵抗性の原因になる。
- バイオマーカー:病気の有無、進行度、治療効果などを判断するための指標となる体内の物質や状態のこと。
- 胚性休止期:胚の発生段階で発育が一時的に停止している状態。胚は外界からの影響を受けにくく安定した状態を維持する。
- 異種移植モデル:ヒトの腫瘍細胞を免疫不全マウスに移植して、ヒトのがん組織を再現するモデルとして広く利用されている。
- シスプラチン:がん細胞のDNAと結合して複製を阻害することでがん細胞を死滅させる抗がん剤。
- mTOR阻害剤:mTORは、細胞の成長や増殖を調節する重要なタンパク質である。mTOR阻害剤は、がん細胞の増殖を抑える効果が期待されている。
- TNM分類:がんの進行度を評価するための国際的基準。T (Tumor): 原発巣の大きさや広がり、N (lymph node):リンパ節への転移の有無や広がり、M (Metastasis): 遠隔臓器への転移の有無を表す。